Los canales iónicos —unas proteínas integrales que se encuentran en la membrana celular— son esenciales en múltiples procesos, como la actividad cardíaca, la transmisión nerviosa, la proliferación celular o la regulación de la presión sanguínea. Un estudio publicado ahora en la revista Science Advances describe por primera vez los mecanismos de asociación y tráfico de membrana de la corriente cardíaca IKs, un flujo de iones de potasio a través de canales iónicos en la membrana celular que es decisivo para la correcta función cardiovascular.
Estos mecanismos moleculares relacionados con la fisiología cardíaca han sido caracterizados por un equipo de expertos del Laboratorio de Fisiología Molecular de la Facultad de Biología y del Instituto de Biomedicina de la Universidad de Barcelona (IBUB), bajo la dirección del catedrático Antonio Felipe, del Departamento de Bioquímica y Biomedicina Molecular. En este trabajo también ha participado Carmen Valenzuela, investigadora del CIBERCV en el Instituto de Investigaciones Biomédicas Alberto Sols (CSIC-UAM).
También participan en el estudio expertos de la Facultad de Medicina y Ciencias de la Salud y del Instituto de Neurociencias (UBNeuro) de la UB; el Instituto de Investigaciones Biomédicas August Pi i Sunyer (IDIBAPS); la Universidad de Exeter (Reino Unido), y el Instituto Nacional de Salud de los Estados Unidos en Bethesda (NHI).
Canales iónicos: fronteras de paso en las membranas celulares
Los canales de potasio dependientes de voltaje (Kv) regulan la transmisión del impulso nervioso y el potencial de acción cardíaco mediante el paso de iones K a través de la membrana plasmática que envuelve las células.
La actividad de estos canales de potasio es fundamental en los procesos relacionados con la transmisión sináptica, la fisiología cerebral y el potencial de acción cardíaco. Aunque su función fisiológica parece estar clara en células de naturaleza eléctrica, «su papel es todavía incierto en otros tipos celulares en los que se han podido detectar», detalla el catedrático Antonio Felipe.
En concreto, el canal Kv7.1 (KCNQ1) y su subunidad reguladora KCNE1 generan la corriente IKs del corazón, un flujo eléctrico que participa en la repolarización del miocardio y que interviene en el intervalo QT del potencial de acción cardíaco. Cuando este intervalo se muestra alterado —QT largo o QT corto—, se pueden originar importantes patologías cardíacas (arritmias cardíacas, muerte súbita, etc.).
«Conocer la naturaleza y el funcionamiento de estas proteínas es esencial para entender, diagnosticar y tratar este tipo de patologías, que tienen un gran impacto social», subraya Antonio Felipe.
Complejo Kv7.1-KCNE1: un mecanismo de procesado no convencional
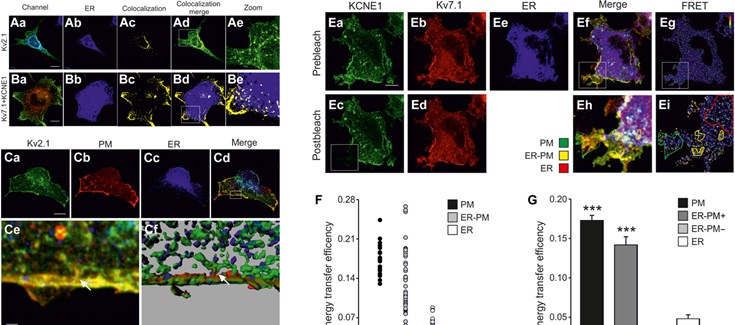
El nuevo estudio describe cómo el canal Kv7.1 se emplaza en la membrana celular mediante un mecanismo no convencional desconocido hasta ahora. Dicho mecanismo implica una ruta alternativa que evita la ruta clásica del aparato de Golgi, un orgánulo integrado por un sistema de cisternas aplanadas y vesículas en el citoplasma celular. Por su parte, la subunidad reguladora KCNE1 sigue un mecanismo tradicional de procesado a través de este orgánulo, que está relacionado con la biosíntesis y el transporte de moléculas esenciales para la fisiología celular.
El nuevo estudio describe cómo el canal Kv7.1 (KCNQ1) y su subunidad reguladora KCNE1 se asocian en dominios muy específicos del retículo endoplasmático, un sistema formado por una compleja red de membranas y relacionado también con la síntesis y el transporte de proteínas.
Estos dominios especializados se localizan muy cerca de la superficie celular y son proyecciones de contacto entre el retículo endoplasmático y la membrana celular (endoplasmic reticulum-plasma membrane junctions, ER-PM). Estas regiones celulares son zonas de ensamblaje del canal Kv7.1 (KCNQ1) con su subunidad reguladora KCNE1 y se utilizan como paso previo a la translocación de este complejo proteico a la membrana plasmática para que este canal iónico desarrolle su función fisiológica esencial.
«Este exclusivo mecanismo no convencional descrito en el nuevo trabajo explica la localización de este importante canal iónico en regiones específicas de las células del músculo cardíaco —por ejemplo, los túbulos T o transversales— y su función en las rutas de señalización del calcio durante el potencial de acción cardíaco», concluye Antonio Felipe.
Artículo de referencia:
Anna Oliveras, A.; Serrano-Novillo, C.; Moreno, C.; De la Cruz, A.; Valenzuela, C.; Soeller, C.; Comes, N., y Felipe, A. «The unconventional biogenesis of Kv7.1-KCNE1 complexes». Science Advances, abril de 2020. Doi: 10.1126/sciadv.aay4472