Investigadores del CIBERCV han estudiado los efectos funcionales cardíacos de la administración de células madre mesenquimales en un modelo traslacional de infarto agudo de miocardio en cerdo. En el estudio, coordinado por Montserrat Rigol (IDIBAPS/ Hospital Clínic), han participado investigadores del grupo liderado por Borja Ibáñez en el CNIC, así como Santiago Roura y Antonio Bayés, del Institut Germans Trias i Pujol de Badalona, entre otros.
A través de este estudio, se ha caracterizado, a corto y largo plazo, cuáles son los mecanismos paracrinos, la respuesta inmunológica y los efectos funcionales cardíacos de la administración intracoronaria de células madre mesenquimales derivadas del tejido adiposo alogénicas y han demostrado que su administración a los 15 minutos de la reperfusión post-infarto agudo de miocardio en un modelo animal traslacional es un tratamiento seguro, factible y beneficioso. De ser confirmada su utilidad en el escenario clínico, este abordaje podría simplificar la metodología usada en otros tratamientos post-infarto en el campo de investigación de la terapia celular.
Tal y como han señalado los autores de este artículo: “esta terapia evitaría reintervenciones posteriores a la angioplastia primaria, ya que en la misma intervención de revascularización se podrían administrar las células. Sin embargo, para poder realizar esta terapia de manera inmediata, es necesaria la utilización de células alogénicas (distintas a las del receptor) para que estén disponibles cuando el paciente las necesite”.
Como demuestran los investigadores, el tratamiento con células alogénicas no se asocia con complicaciones y presenta una tasa muy baja de alosensibilización, sin aumento del rechazo celular. Por lo tanto, este tratamiento aportaría potencialmente muchas ventajas a la práctica clínica. Aparte de reducir el tiempo de espera, se podrían evitar las intervenciones para obtener células autólogas con sus potenciales complicaciones. Asimismo, las células se podrían obtener de donantes sanos y jóvenes, que se ha demostrado que tienen mayor potencial regenerativo que las de los pacientes con enfermedades cardiovasculares.
En conclusión, el efecto antiapoptótico que ejercen las células madre mesenquimales derivadas del tejido adiposo a los 2 días del infarto, se podría traducir en una mejora de la supervivencia del tejido miocárdico afectado. Además, se ha evidenciado que esta terapia mejora significativamente la vascularización miocárdica y, en consecuencia, la perfusión en las zonas de transición del tejido sano al infartado. Este efecto beneficioso podría derivar en una mayor calidad de vida del paciente, con una mejora de su tolerancia al ejercicio y reducción de los episodios de angina.
Los resultados de este estudio, que ha sido financiado por la Fundació la Marató de TV3, han publicados en Journal of the American Heart Association.
Referencia bibliográfica:
Bobi J and Solanes N, Fernández-Jiménez R, Galán-Arriola C, Dantas AP, Fernández-Friera L, Gálvez-Montón C, Rigol-Monzó E, Agüero J, Ramírez J, Roqué M, Bayés-Genís A, Sánchez-González J, García-Álvarez A, Sabaté M, Roura S, Ibáñez B, Rigol M. Intracoronary Administration of Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells Improves Myocardial Perfusion But Not Left Ventricle Function, in a Translational Model of Acute Myocardial Infarction. J Am Heart Assoc. 2017 May 3;6(5). pii: e005771. doi: 10.1161/JAHA.117.005771 http://jaha.ahajournals.org/content/6/5/e005771.long
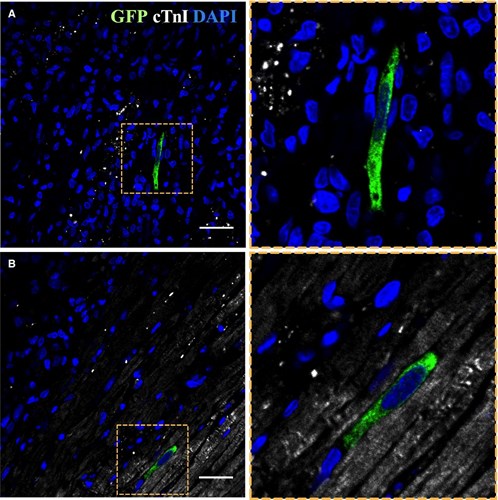
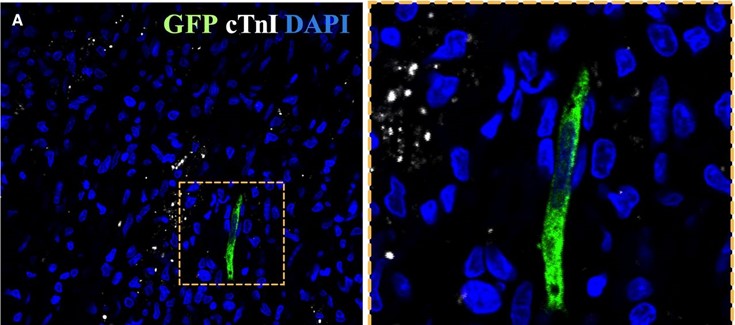
Figura:
ATMSCs implantation in the myocardium. Confocal microscopy images showing GFP‐positive ATMSCs (green) in the infarct area (A) and border zone (B) (cTnI in white and nuclei counterstained with DAPI in blue). Right panels represent zoom images from the left panels. Scale bars, 50 μm. ATMSCs indicates adipose tissue‐derived mesenchymal stem cells; cTnI, cardiac troponin‐I; DAPI, 4′,6‐diamidino‐2‐phenylindole dihydrochloride; GFP, green fluorescent protein.